ロート製薬
皮膚におけるビタミンCの新知見を発表
ロート製薬は、ロートグループ 総合経営ビジョン 2030である「Connect for Well-being」の実現に向けて、ビタミンCの生体内の機能解明に向けた研究を進めている。今回、東京都健康長寿医療センター研究所の石神昭人副所長、佐藤綾美研究員(現:東洋大学准教授)と北陸大学薬学部の佐藤安訓准教授との共同研究にて、ビタミンC(L-アスコルビン酸)がDNAの脱メチル化を介して表皮の細胞増殖を促進し、表皮の厚みを増加させる新たなメカニズムを明らかにした。
同研究成果は、2025年4月20日に皮膚科学において権威のある米国研究皮膚科学会誌「Journal of Investigative Dermatology」(電子版)に掲載された。タイトルは「Vitamin C promotes epidermal proliferation by promoting DNA demethylation of proliferation-related genes in human epidermal equivalents」。
研究成果のポイントは三つ。
◆ビタミンCが表皮角化細胞の増殖を促進し、表皮細胞層の厚みに寄与することを確認
◆ビタミンCは細胞増殖に関連する遺伝子のDNA脱メチル化を介して、表皮角化細胞の増殖を促進することを発見
◆皮膚におけるビタミンCの役割に「エピジェネティクス制御による細胞増殖」が加わり、肌老化への新たな介入法となる可能性を示唆
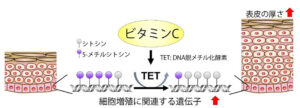
DNAの脱メチル化とは、DNAの塩基の一つである「シトシン」に付加されたメチル基(CH3基)が取り除かれることで、遺伝子の働き(転写)が促進されやすくなる変化を指す。通常、メチル化されたシトシンは5-メチルシトシン(5-mC)と呼ばれ、これは遺伝子を〝オフ〟の状態に保つ役割を持つ。
ビタミンCなどの働きにより、この5-mCがTET酵素によって5-ヒドロキシメチルシトシン(5-hmC)に変換されることで、メチル化が解除(脱メチル化)され、遺伝子が再び〝オン〟になる準備が整う。
このように、5-hmCはDNA脱メチル化のマーカーとしても知られている。
エピジェネティクスとは、DNAの配列を変えずに、どの遺伝子が働くかを制御する仕組み。細胞はこの仕組みを使って、自らの性質を維持したり、環境に応じて柔軟に応答したりしている。近年では老化や疾患にも深く関わることが分かってきている。
ビタミンC(L-アスコルビン酸)は、抗酸化作用やコラーゲン合成促進(Masaki H.Role of antioxidants in the skin: Anti-aging effects.J Dermatol Sci 2010;58(2):85-90.)、紫外線によるダメージ軽減といった機能で広く知られ(Kawashima S, Funakoshi T,Sato Y, Saito N,Ohsawa H,Kurita K,et al. Protective effect of pre- and post-vitamin C treatments on UVB-irradiation-induced skin damage. Sci Rep 2018;8(1):16199.)、スキンケア製品に幅広く利用されてきた。特に表皮においては、紫外線や環境ストレスから細胞を守る働きを持ち、血液中よりも高濃度に蓄積されることが知られている〈Padayatty SJ,Sun H,Wang Y,Riordan HD,Hewitt SM, Katz A, et al.Vitamin C pharmacokinetics:implications for oral and intravenous use. Ann Intern Med 2004;140(7):533-7.〉〈Pullar JM, Carr AC,Vissers MCM.The roles of vitamin C in skin health.Nutrients 2017;9(8).〉。これは、ビタミンCが肌の恒常性維持において重要な役割を果たしていることを示唆している。
近年では、ビタミンCがDNA脱メチル化酵素(TET:Ten-eleven translocation)の補因子として働くことが報告されており、幹細胞の初期化やがん研究など、さまざまな分野で注目されている(Lee Chong T,Ahearn EL, Cimmino L.Reprogramming the epigenome with vitamin C.Front Cell Dev Biol 2019;7:128.)。一方で、ヒト表皮角化細胞におけるビタミンCのエピジェネティックな役割は、これまでほとんど明らかにされていなかった。
そこで同研究では、ヒト三次元培養表皮モデルと網羅的な解析技術を用いて、ビタミンCが表皮角化細胞にどのような影響を与えるのか、さらにその背景にあるエピジェネティックな変化がどのように関与しているのかを明らかにすることを目的とした。
ヒトの表皮を模したヒト三次元培養表皮モデルを構築し、表皮角化細胞におけるビタミンCのエピジェネティック制御に関する役割を調べた。その結果、細胞にビタミンCが取り込まれると、表皮の厚み、細胞の増殖、およびDNA脱メチル化の指標である5-ヒドロキシメチルシトシン(5-hmc)が増加した。また、この効果はDNA脱メチル化酵素の阻害剤により減弱した。以上の結果により、ビタミンCがTET依存的にDNA脱メチル化を促進していることが明らかになった。
さらに、ビタミンCがどのように遺伝子を制御しているかを調べるため、マイクロアレイ解析および全ゲノムバイサルファイトシーケンス(WGBS:Whole-genome bisulfite sequencing)解析を行った。
マイクロアレイ解析とは、数千〜数万の遺伝子の発現量を同時に測定できる解析手法。遺伝子発現の増減を網羅的に調べることで、特定の処理(例:ビタミンC添加)が細胞に与える影響を可視化できる。
WGBS解析とは、DNA全体のメチル化状態を塩基レベルで網羅的に解析する手法。ビスルファイト処理によりメチル化されたサイトを識別し、ゲノム全体のメチル化パターンを可視化する。
解析の結果、細胞増殖に関連する12遺伝子の発現がビタミンCにより増加することが分かった。
同研究により、ビタミンCがTET酵素を介してDNAの脱メチル化を促進し、それにより表皮細胞の増殖や表皮構造の厚みを増加させることが考えられる。さらに、増殖関連遺伝子の脱メチル化と発現促進が示されたことから、エピジェネティクスの観点からも表皮におけるビタミンCの新たな意義が見出された。ビタミンCがもつ抗酸化作用にとどまらず、新たに〝エピジェネティック制御〟という生体内で起こりうる機能に注目したものであり、肌の老化やバリア機能の低下といった課題への根本的なアプローチにつながる可能性がある(図)。
同研究は、エピジェネティクスという可逆的な遺伝子制御メカニズムを介して、ビタミンCが表皮に与える影響を包括的に示した。エピジェネティックな変化は、皮膚に存在する多様な細胞の運命を時空間的に制御しており、可逆的であることから、加齢に伴う細胞機能の変化を再構築する手段として注目されている。同研究により、ビタミンCによるエピジェネティック制御を活用した臨床応用やスキンケアへの新たな戦略の可能性が示唆され、生活の質(QOL)の改善とともに、心身ともに健康で豊かな健康長寿社会の実現に貢献すると期待できる。